Kecepatan reaksi dipengaruhi oleh faktor berikut kecuali – Kecepatan reaksi dipengaruhi faktor berikut kecuali warna reaktan. Reaksi kimia, proses transformasi zat, ternyata dipengaruhi berbagai faktor. Bayangkan, sebuah reaksi bisa berlangsung cepat atau lambat tergantung kondisi lingkungannya. Kita akan membahas beberapa faktor kunci yang menentukan kecepatan reaksi, mulai dari konsentrasi zat pereaksi hingga peran katalis yang menakjubkan.
Pemahaman tentang faktor-faktor ini sangat penting, baik dalam konteks laboratorium maupun industri. Dengan mengontrol faktor-faktor ini, kita bisa mengatur kecepatan reaksi sesuai kebutuhan. Misalnya, dalam industri farmasi, mengendalikan kecepatan reaksi sangat krusial untuk menghasilkan produk dengan kualitas dan kuantitas yang diinginkan.
Pengaruh Konsentrasi Reaktif
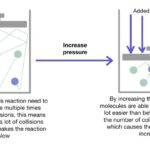
Kecepatan reaksi kimia, yaitu seberapa cepat reaktan berubah menjadi produk, sangat dipengaruhi oleh berbagai faktor. Salah satu faktor yang paling signifikan adalah konsentrasi reaktan. Konsentrasi yang lebih tinggi umumnya berujung pada reaksi yang lebih cepat. Mari kita bahas lebih detail bagaimana hal ini terjadi.
Hubungan Konsentrasi Reaktan dan Kecepatan Reaksi
Konsentrasi reaktan secara langsung memengaruhi frekuensi tumbukan antar partikel reaktan. Semakin tinggi konsentrasi, semakin banyak partikel reaktan yang ada dalam suatu volume tertentu. Akibatnya, peluang terjadinya tumbukan antar partikel yang cukup energik untuk memulai reaksi akan meningkat. Peningkatan frekuensi tumbukan efektif ini, yang merupakan tumbukan dengan energi kinetik minimal (energi aktivasi), secara langsung meningkatkan kecepatan reaksi.
Contoh Reaksi Kimia
Reaksi antara asam klorida (HCl) dan magnesium (Mg) merupakan contoh yang baik. Reaksi ini menghasilkan gas hidrogen (H 2): 2HCl(aq) + Mg(s) → MgCl 2(aq) + H 2(g). Jika kita meningkatkan konsentrasi asam klorida, kita akan mengamati bahwa produksi gas hidrogen berlangsung lebih cepat. Hal ini karena lebih banyak ion H + tersedia untuk bereaksi dengan magnesium.
Perbandingan Kecepatan Reaksi pada Berbagai Konsentrasi
| Konsentrasi HCl (M) | Kecepatan Reaksi (mL H2/menit) | Suhu (°C) | Kondisi |
|---|---|---|---|
| 0.5 | 10 | 25 | Kondisi standar |
| 1.0 | 20 | 25 | Kondisi standar |
| 1.5 | 30 | 25 | Kondisi standar |
| 2.0 | 40 | 25 | Kondisi standar |
Catatan: Data di atas merupakan data ilustrasi. Kecepatan reaksi yang sebenarnya dapat dipengaruhi oleh faktor lain seperti suhu dan luas permukaan.
Ilustrasi Peningkatan Frekuensi Tumbukan
Bayangkan dua kelompok bola biliar. Satu kelompok terdiri dari sedikit bola, sementara kelompok lainnya terdiri dari banyak bola. Jika kita menggoyangkan kedua kelompok tersebut, kelompok dengan banyak bola akan memiliki lebih banyak tumbukan antar bola dibandingkan dengan kelompok yang sedikit bola. Hal ini serupa dengan reaksi kimia. Peningkatan konsentrasi reaktan seperti meningkatkan jumlah bola biliar, sehingga meningkatkan frekuensi tumbukan dan kecepatan reaksi.
Pengaruh Konsentrasi Reaksi terhadap Energi Aktivasi
Penting untuk diingat bahwa peningkatan konsentrasi reaktan
-tidak* mengubah energi aktivasi reaksi. Energi aktivasi adalah energi minimum yang dibutuhkan agar reaksi dapat berlangsung. Namun, peningkatan konsentrasi meningkatkan kemungkinan tumbukan yang memiliki energi kinetik melebihi energi aktivasi, sehingga meningkatkan jumlah tumbukan efektif dan dengan demikian mempercepat reaksi.
Pengaruh Luas Permukaan Kontak

Kecepatan reaksi kimia, yaitu seberapa cepat reaksi berlangsung, dipengaruhi oleh berbagai faktor. Salah satu faktor penting yang seringkali diabaikan adalah luas permukaan kontak antar reaktan. Luas permukaan yang lebih besar dapat secara signifikan mempercepat reaksi, terutama ketika melibatkan zat padat yang bereaksi dengan zat cair atau gas.
Pengaruh Luas Permukaan terhadap Kecepatan Reaksi
Reaksi kimia terjadi ketika partikel-partikel reaktan saling bertabrakan dan berinteraksi. Semakin banyak partikel yang dapat bertabrakan dalam waktu tertentu, semakin cepat reaksi akan berlangsung. Pada reaksi yang melibatkan zat padat, luas permukaan menentukan jumlah partikel yang terekspos dan siap bereaksi. Semakin besar luas permukaan, semakin banyak partikel yang dapat berinteraksi, sehingga kecepatan reaksi meningkat.
Contoh Reaksi Padatan dan Cairan
Perhatikan reaksi antara logam magnesium (Mg) dengan larutan asam klorida (HCl). Magnesium padat akan bereaksi dengan asam klorida membentuk gas hidrogen (H 2) dan larutan magnesium klorida (MgCl 2). Jika kita menggunakan magnesium dalam bentuk serbuk halus, reaksi akan berlangsung jauh lebih cepat dibandingkan jika kita menggunakan magnesium dalam bentuk bongkahan besar. Hal ini karena serbuk magnesium memiliki luas permukaan yang jauh lebih besar daripada bongkahan magnesium, sehingga lebih banyak partikel magnesium yang dapat berkontak dengan asam klorida.
Perbandingan Kecepatan Reaksi: Padatan Halus vs. Kasar
Berikut ilustrasi perbandingan kecepatan reaksi antara padatan yang berbentuk butiran halus dan butiran kasar:
| Jenis Padatan | Luas Permukaan | Kecepatan Reaksi | Ilustrasi |
|---|---|---|---|
| Butiran Kasar | Kecil | Lambat | Bayangkan sebuah batu besar yang direaksikan dengan cairan. Hanya sebagian kecil permukaan batu yang berkontak dengan cairan. |
| Butiran Halus | Besar | Cepat | Bayangkan serbuk halus yang sama direaksikan dengan cairan. Seluruh permukaan serbuk berkontak dengan cairan, menghasilkan luas permukaan sentuh yang jauh lebih besar. |
Mekanisme Peningkatan Kecepatan Reaksi
Peningkatan luas permukaan mempercepat laju reaksi karena meningkatkan frekuensi tumbukan antar partikel reaktan. Dengan lebih banyak partikel yang terekspos dan dapat berinteraksi, peluang terjadinya tumbukan yang efektif (tumbukan yang menghasilkan reaksi) meningkat secara signifikan. Ini analog dengan meningkatkan konsentrasi reaktan, meskipun mekanismenya berbeda.
Reaksi yang Dipengaruhi Luas Permukaan
Banyak reaksi kimia yang sangat dipengaruhi oleh luas permukaan sentuh, terutama reaksi yang melibatkan padatan. Contohnya adalah pembakaran bahan bakar, korosi logam, dan reaksi antara asam dengan logam. Dalam industri, prinsip ini dimanfaatkan untuk mengoptimalkan kecepatan reaksi, misalnya dengan menggunakan katalis yang memiliki luas permukaan yang sangat besar untuk mempercepat proses produksi.
Pengaruh Suhu
Suhu merupakan faktor penting yang memengaruhi kecepatan reaksi kimia. Peningkatan suhu umumnya akan mempercepat reaksi, sementara penurunan suhu akan memperlambatnya. Hal ini berkaitan erat dengan energi kinetik partikel-partikel yang bereaksi.
Suhu dan Energi Kinetik Partikel
Energi kinetik adalah energi yang dimiliki oleh suatu benda karena gerakannya. Partikel-partikel dalam suatu zat, baik berupa atom, ion, maupun molekul, selalu bergerak. Semakin tinggi suhu suatu zat, semakin tinggi energi kinetik rata-rata partikel-partikelnya. Artinya, partikel-partikel tersebut bergerak lebih cepat dan lebih sering bertabrakan.
Tabrakan antar partikel merupakan syarat utama terjadinya reaksi kimia. Namun, tidak semua tabrakan menghasilkan reaksi. Hanya tabrakan yang memiliki energi kinetik minimum, yang disebut energi aktivasi, yang dapat menghasilkan produk reaksi.
Hubungan Suhu dan Kecepatan Reaksi
Grafik hubungan antara suhu dan kecepatan reaksi umumnya berbentuk kurva eksponensial. Semakin tinggi suhu, semakin banyak partikel yang memiliki energi kinetik melebihi energi aktivasi, sehingga semakin banyak tabrakan efektif yang terjadi dan semakin cepat reaksi berlangsung. Grafik tersebut menunjukkan peningkatan kecepatan reaksi yang signifikan seiring peningkatan suhu, meskipun peningkatannya tidak linear.
Sebagai ilustrasi, bayangkan grafik dengan sumbu X mewakili suhu (dalam Kelvin) dan sumbu Y mewakili kecepatan reaksi (misalnya, dalam mol/liter/detik). Kurva akan dimulai dari titik rendah pada suhu rendah dan naik secara tajam seiring peningkatan suhu, menunjukkan peningkatan kecepatan reaksi yang eksponensial.
Pengaruh Suhu terhadap Energi Aktivasi
Suhu tidak mengubah nilai energi aktivasi (Ea) suatu reaksi. Energi aktivasi adalah energi minimum yang dibutuhkan agar reaksi dapat berlangsung. Namun, suhu memengaruhi
-fraksi* partikel yang memiliki energi kinetik yang cukup untuk mengatasi energi aktivasi. Semakin tinggi suhu, semakin besar fraksi partikel yang memiliki energi kinetik ≥ Ea, sehingga kecepatan reaksi meningkat.
Contoh Reaksi Sensitif Terhadap Perubahan Suhu
Banyak reaksi kimia sangat sensitif terhadap perubahan suhu. Salah satu contohnya adalah pembakaran. Reaksi pembakaran bahan bakar, seperti kayu atau gas, akan berlangsung jauh lebih cepat pada suhu tinggi. Suhu yang cukup tinggi diperlukan untuk memulai reaksi pembakaran, dan kecepatan reaksi akan meningkat secara drastis seiring dengan peningkatan suhu.
Contoh lain adalah reaksi dekomposisi hidrogen peroksida (H₂O₂). Dekomposisi H₂O₂ menjadi air (H₂O) dan oksigen (O₂) dipercepat secara signifikan dengan peningkatan suhu. Pada suhu kamar, reaksi ini berlangsung lambat, tetapi pada suhu yang lebih tinggi, reaksi akan berlangsung jauh lebih cepat.
Pengaruh Katalis
Kecepatan reaksi kimia dapat dipengaruhi oleh berbagai faktor, salah satunya adalah penggunaan katalis. Katalis merupakan zat yang dapat mempercepat laju reaksi tanpa mengalami perubahan kimiawi secara permanen setelah reaksi selesai. Peran katalis sangat penting dalam berbagai proses industri dan biologi, karena kemampuannya untuk meningkatkan efisiensi reaksi dan mengurangi kebutuhan energi.
Peran Katalis dalam Mempercepat Reaksi
Katalis bekerja dengan menurunkan energi aktivasi suatu reaksi. Energi aktivasi adalah energi minimum yang dibutuhkan agar reaksi kimia dapat berlangsung. Dengan menurunkan energi aktivasi, katalis memungkinkan lebih banyak molekul reaktan untuk mencapai keadaan transisi dan bereaksi, sehingga meningkatkan laju reaksi. Katalis mencapai hal ini dengan menyediakan jalur reaksi alternatif yang memiliki energi aktivasi lebih rendah daripada jalur reaksi tanpa katalis.
Contoh Reaksi Kimia dengan Katalis dan Mekanisme Kerjanya
Salah satu contoh reaksi yang menggunakan katalis adalah dekomposisi hidrogen peroksida (H₂O₂). Dekomposisi H₂O₂ menjadi air (H₂O) dan oksigen (O₂) secara spontan berlangsung lambat. Namun, jika ditambahkan katalis seperti mangan dioksida (MnO₂), reaksi akan berlangsung jauh lebih cepat. MnO₂ menyediakan permukaan tempat molekul H₂O₂ dapat teradsorpsi dan terurai menjadi H₂O dan O₂, kemudian MnO₂ terlepas tanpa mengalami perubahan kimiawi.
Diagram Energi Potensial Reaksi dengan dan Tanpa Katalis
Diagram energi potensial menggambarkan perubahan energi selama reaksi berlangsung. Untuk reaksi dengan katalis, kurva energi akan menunjukkan energi aktivasi yang lebih rendah dibandingkan dengan reaksi tanpa katalis. Kurva energi untuk reaksi dengan katalis akan memiliki puncak yang lebih rendah, menunjukkan bahwa energi yang dibutuhkan untuk mencapai keadaan transisi lebih sedikit. Perbedaan tinggi puncak antara kedua kurva mewakili perbedaan energi aktivasi.
Bayangkan sebuah grafik dengan sumbu X mewakili kemajuan reaksi dan sumbu Y mewakili energi potensial. Kurva untuk reaksi tanpa katalis akan menunjukkan puncak yang tinggi mewakili energi aktivasi yang tinggi. Kurva untuk reaksi dengan katalis akan menunjukkan puncak yang lebih rendah dan lebih landai, menunjukkan energi aktivasi yang lebih rendah. Kedua kurva akan memiliki titik awal dan akhir yang sama, yang menunjukkan bahwa perubahan energi total reaksi tetap sama, hanya jalur reaksi yang berbeda.
Perbandingan Kecepatan Reaksi dengan dan Tanpa Katalis
| Kondisi | Energi Aktivasi (kJ/mol) | Kecepatan Reaksi (satuan arbitrer) | Keterangan |
|---|---|---|---|
| Tanpa Katalis | 75 | 1 | Reaksi berlangsung lambat |
| Dengan Katalis | 25 | 100 | Reaksi berlangsung sangat cepat |
Katalis Menurunkan Energi Aktivasi
Katalis menurunkan energi aktivasi dengan menyediakan jalur reaksi alternatif yang memiliki energi aktivasi lebih rendah. Jalur reaksi alternatif ini biasanya melibatkan pembentukan kompleks antara katalis dan reaktan, yang kemudian terurai membentuk produk dan melepaskan katalis. Pembentukan kompleks ini menurunkan energi yang dibutuhkan untuk mencapai keadaan transisi, sehingga mempercepat laju reaksi. Proses ini dapat dianalogikan seperti membangun terowongan melalui gunung untuk memperpendek jarak tempuh, terowongan tersebut mewakili katalis yang menyediakan jalur reaksi alternatif dengan energi aktivasi yang lebih rendah.
Faktor yang TIDAK Mempengaruhi Kecepatan Reaksi: Kecepatan Reaksi Dipengaruhi Oleh Faktor Berikut Kecuali
Kecepatan reaksi, laju perubahan konsentrasi reaktan atau produk per satuan waktu, dipengaruhi oleh berbagai faktor. Namun, ada beberapa hal yang secara umum dianggap
-tidak* berpengaruh pada kecepatan reaksi. Pemahaman tentang faktor-faktor ini penting untuk mengontrol dan memprediksi laju reaksi kimia dalam berbagai aplikasi, mulai dari industri hingga laboratorium.
Secara umum, faktor-faktor yang mempengaruhi kecepatan reaksi meliputi konsentrasi reaktan, suhu, luas permukaan sentuh (untuk reaktan padat), dan keberadaan katalis. Namun, ada satu faktor yang umumnya tidak mempengaruhi kecepatan reaksi, yaitu nama atau identitas kimiawi wadah reaksi.
Identifikasi Faktor yang Tidak Mempengaruhi Kecepatan Reaksi
Faktor yang tidak mempengaruhi kecepatan reaksi adalah identitas wadah reaksi (asalkan wadah tersebut inert dan tidak bereaksi dengan reaktan). Artinya, reaksi kimia akan berlangsung dengan kecepatan yang sama di dalam wadah kaca, wadah plastik (yang inert), atau wadah logam (yang inert) selama kondisi reaksi lainnya (suhu, konsentrasi, dll.) dijaga konstan.
Penjelasan dan Contoh Reaksi Kimia, Kecepatan reaksi dipengaruhi oleh faktor berikut kecuali
Kecepatan reaksi bergantung pada frekuensi tumbukan antar partikel reaktan yang memiliki energi kinetik minimal (energi aktivasi). Identitas wadah reaksi tidak akan mengubah energi kinetik partikel reaktan atau frekuensi tumbukan antar mereka, asalkan wadah tersebut tidak bereaksi dengan reaktan atau produk. Sebagai contoh, perhatikan reaksi antara asam klorida (HCl) dan magnesium (Mg):
2HCl(aq) + Mg(s) → MgCl₂(aq) + H₂(g)
Reaksi ini akan berlangsung dengan kecepatan yang sama baik dalam tabung reaksi kaca maupun dalam wadah plastik inert. Kecepatan reaksi ditentukan oleh konsentrasi HCl, luas permukaan Mg, dan suhu, bukan oleh material wadah reaksi.
Reaksi kimia berlangsung berdasarkan interaksi antar partikel reaktan, bukan interaksi dengan wadah reaksi. Asalkan wadah bersifat inert, ia tidak akan mempengaruhi kecepatan reaksi.
Tabel Perbandingan Faktor yang Mempengaruhi dan Tidak Mempengaruhi Kecepatan Reaksi
| Faktor | Mempengaruhi Kecepatan Reaksi | Penjelasan |
|---|---|---|
| Konsentrasi Reaksi | Ya | Konsentrasi reaktan yang lebih tinggi meningkatkan frekuensi tumbukan, sehingga meningkatkan kecepatan reaksi. |
| Suhu | Ya | Suhu yang lebih tinggi meningkatkan energi kinetik partikel, sehingga meningkatkan frekuensi tumbukan dan proporsi tumbukan yang efektif. |
| Luas Permukaan | Ya (untuk reaktan padat) | Luas permukaan yang lebih besar meningkatkan jumlah partikel yang tersedia untuk bereaksi, sehingga meningkatkan kecepatan reaksi. |
| Katalis | Ya | Katalis menyediakan jalur reaksi alternatif dengan energi aktivasi yang lebih rendah, sehingga meningkatkan kecepatan reaksi. |
| Identitas Wadah Reaksi (jika inert) | Tidak | Wadah inert tidak berpartisipasi dalam reaksi dan tidak mempengaruhi energi kinetik atau frekuensi tumbukan partikel reaktan. |
Akhir Kata

Kesimpulannya, kecepatan reaksi kimia merupakan proses yang kompleks dan dipengaruhi oleh berbagai faktor. Memahami faktor-faktor ini memungkinkan kita untuk mengendalikan dan memanipulasi kecepatan reaksi sesuai kebutuhan. Dari konsentrasi reaktan, luas permukaan, suhu, hingga peran katalis, semuanya berperan penting dalam menentukan seberapa cepat atau lambat suatu reaksi berlangsung. Warna reaktan, sebaliknya, tidak memberikan pengaruh signifikan terhadap kecepatan reaksi itu sendiri.
